\( \require{mhchem} \)
.
Οι δεσμοί σ, στη χημεία, είναι ο ισχυρότερος τύπος ομοιοπολικού δεσμού[1]. Σχηματίζονται με «επικάλυψη» μεταξύ ατομικών τροχιακών. Οι σ δεσμοί ορίζονται πιο καθάρά για διατομικά μόρια, χρησιμοποιώντας την ορολογία και τα εργαλεία της συμμετρίας ομάδων. Σε αυτήν τη τυπική προσέγγιση, ένας δεσμός σ είναι συμμετρικός επιτρέποντας την περιστροφή γύρω από το δεσμικό του άξονα. Σύμφωνα με αυτόν τον ορισμό, οι συνηθισμένες μορφές των δεσμών σ είναι s + s, pz + pz, s + pz και dz2 + dz2 (όπου ο άξονας z ορίστηκε ως ο δεσμικός άξονας)[2]. Η κβαντική θεωρία υποδεικνύει ότι τα μοριακά τροχιακά (Molecular Orbital: MO) της ταυτόσημης συμμετρίας ουσιαστικά αναμιγνύονται. Ως μια πρακτική συνέπεια αυτής της μίξης των διατομικών μορίων, αναμιγνύονται οι κυματοσυναρτήσεις των μοριακών τροχιακών s + s και pz + pz. Η επέκταση αυτής της μίξης εξαρτάται από τις σχετικές ενέργειες των παρόμοιας συμμετρίας μοριακών τροχιακών.
Για ομοδιατομικά μόρια[3], τα τροχιακά των δεσμών σ δεν έχουν δεσμικά διαγράμματα στα οποία η κυματοσυνάρτηση παίρνει την τιμή 0, ούτε μεταξύ των δυο συνδεμένων ατόμων ούτε περνώντας διαμέσου των συνδεμένων ατόμων. Το συζυγές αντιδεσμικό τροχιακό σ*, ορίζεται από την παρουσία ενός ενός δεσμικού πλάνου ανάμεσα στα δυο συνδεμένα άτομα.
Οι δεσμοί σ είναι ο ισχυρότερος τύπος ομοιοπολικού δεσμού χάρει στην απευθείας επικάλυψη των τροχιακών, και τα ηλεκτρόνια που συνεισφέρονται για τη δημιουργία αυτών των δεσμών σ συχνά αναφέρονται ως «ηλεκτρόνια σ»[4].
Το σύμβολο σ προέρχεται από το ελληνικό γράμμα «σ», γιατί όταν βλέπεται προς τα κάτω σε σχέση με το δεσμικό του άξονα, ένα μοριακό τροχιακό σ έχει κυκλική συμμετρία, οπότε μοιάζει με το ατομικό τροχιακό s.

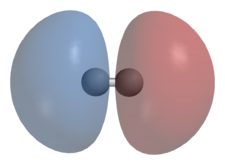
Δεσμός σ μεταξύ δύο ατόμων: Εντοπισμός της ηλεκτρονιακής πυκνότητας
Σε πολυατομικές ενώσεις
Οι πολυατομικές ενώσεις σχηματίζονται με απευθείας επικάλυψη ατομικών τροχιακών. Η έννοια των δεσμών σ επεκτείνεται για να περιγράψει τις δεσμικές αλληλεπιδράσεις που περιλαμβάνουν επικαλύψεις ενός απλού λοβού του ενός τροχιακού με τον απλό λοβό ενός άλλου. Για παράδειγμα, το προπάνιο περιγράφεται αποτελούμενο από 10 δεσμούς σ, από ένα για τον καθένα από τους 2 δεσμούς C-C, και από έναν για έναν για τον καθένα από τους 8 δεσμούς C-H που το μόριο αυτό περιέχει. Όπως είναι φανερό η έννοια των δεσμών σ είναι ισχυρή και γι' αυτό διάχυτη στη χημεία.
Σε πολύπλοκα συνδεμένα χημικά είδη
Τα ενώσεις που περιλαμβάνουν πολύπλοκους δεσμούς, όπως για είναι τα σύμπλοκα διυδρογόνου, έχουν δεσμούς σ μεταξύ πολύπλοκα συνδεμένων ατόμων. Αυτοί οι δεσμοί σ, όμως, μπορεί να συμπληρώνονται από άλλες αλληλεπιδράσεις, όπως από δεσμούς επιστροφής π, όπως για παράδειγμα στην περίπτωση της ένωσης [W(CO)3(PCy3)2(H2)][5], ή ακόμη και δεσμούς δ, όπως για παράδειγμα στην περίπτωση του (δι)αιθανικού χρωμίου [(CH3COO)2Cr][6].
Σε οργανικά μόρια
Τα οργανικά μόρια αντιστοιχούν συχνά σε κυκλικές ενώσεις, δηλαδή ενώσεις που περιέχουν έναν ή περισσότερους δακτύλιους, όπως το βενζόλιο, και συχνά αποτελούνται από πολλούς δεσμούς σ και ίσως μαζί με δεσμούς π. Σύμφωνα με τον κανόνα των δεσμών σ, «ο αριθμός των δεσμών σ ενός μοριου είναι ίσος με τον αριθμό των ατόμων του, συν τον αριθμό των δακτυλίων του, πλην 1.». Δηλαδή:
\( \mathrm{N_{\sigma} = N_{\alpha \tau} + N_{\delta} - 1} \)
Όπου Nσ ο αριθμός των δεσμών σ της ένωσης, Nατ ο αριθμός των ατόμων της ένωσης και Nδ ο αριθμός των δακτυλίων της ένωσης.Μόρια με δακτυλίους έχουν επιπλέον δεσμούς σ, γι' αυτό και προστίθεται ο Nδ. Έτσι, για παράδειγμα το βενζόλιο (C6H6) έχει 12 δεσμούς σ (= 12 άτομα + 1 δακτυλιος - 1) και το μόριο του ανθρακένιου (C14H10) που έχει 3 δακτυλίους, ο κανόνας δίνει σωστά 26 δεσμούς σ (= 24 άτομα + 3 δακτύλιοι - 1). Πιο συγκεκριμένα περιέχει 16 δεσμούς σ C-C και 10 δεσμούς σ C-H.
Σε ένα μόριο χωρίς δακτυλίους είναι βέβαια Nδ = 0. Έτσι για παράδειγμα το (δι)υδρογόνο (H2) έχει μόνο 1 δεσμό σ (2 άτομα - 1 = 1) και η αμμωνία (NH3) έχει 3 δεσμούς σ (= 4 άτομα - 1).
Μόρια με δακτυλίους έχουν επιπλέον δεσμούς σ, γι' αυτό και προστίθεται ο Nδ. Έτσι, για παράδειγμα το βενζόλιο (C6H6) έχει 12 δεσμούς σ (= 12 άτομα + 1 δακτυλιος - 1) και το μόριο του ανθρακένιου (C14H10) που έχει 3 δακτυλίους, ο κανόνας δίνει σωστά 26 δεσμούς σ (= 24 άτομα + 3 δακτύλιοι - 1). Πιο συγκεκριμένα περιέχει 16 δεσμούς σ C-C και 10 δεσμούς σ C-H.
Δείτε ακόμη
Μοριακή γεωμετρία
Εξωτερικός σύνδεσμος
IUPAC-definition| Ορισμός IUPAC
Αναφορές και σημειώσεις
Moore, John; Stanitski, Conrad L.; Jurs, Peter C. Principles of Chemistry: The Molecular Science.
Clayden, Jonathan; Greeves, Nick; Warren, Stuart (March 2012) [2002]. Organic Chemistry (2nd ed.). Oxford: OUP Oxford. pp. 101–136. ISBN 978-0199270293.
Διατομικά μόρια μεταξύ όμοιων ατόμων, π.χ. H - H.
Keeler, James; Wothers, Peter (May 2008). Chemical Structure and Reactivity (1st ed.). Oxford: OUP Oxford. pp. 27–46. ISBN 978-0199289301.
Όπου Cy κυκλοεξύλιο (C6H11)
Kubas, Gregory (2002). "Metal Dihydrogen and σ-Bond Complexes: Structure, Theory, and Reactivity". JCAS 14: 3799–3800. doi:10.1021/ja0153417.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License

